Repaso de estequiometría.
Introducción a la ingeniería química/de proceso.
Estequiometría.
Repaso.

Repaso. Pregunta 1.
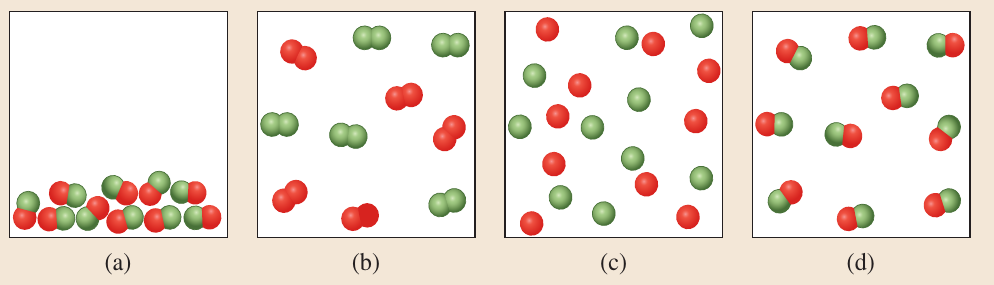
Repaso. Pregunta 2.
¿Cuál de los siguientes fenómenos es una reacción química?
Evaporación del agua.
Combinación de hidrógeno y oxígeno para producir agua.
Disolución de azúcar en agua.
Separación del cloruro de sodio en cloro y sodio.
Combustión de azúcar para formar dióxido de carbono y agua.
Repaso. Pregunta 3.
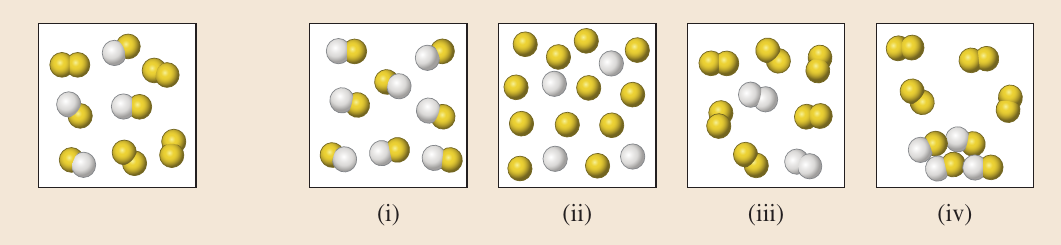
Repaso. Pregunta 4.
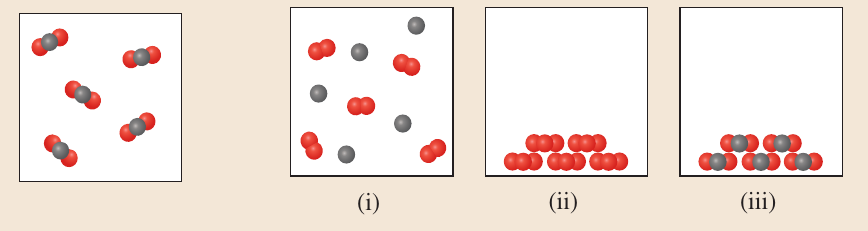
Repaso. Pregunta 5.
\[ CO+O_2 \rightarrow CO_2 \]
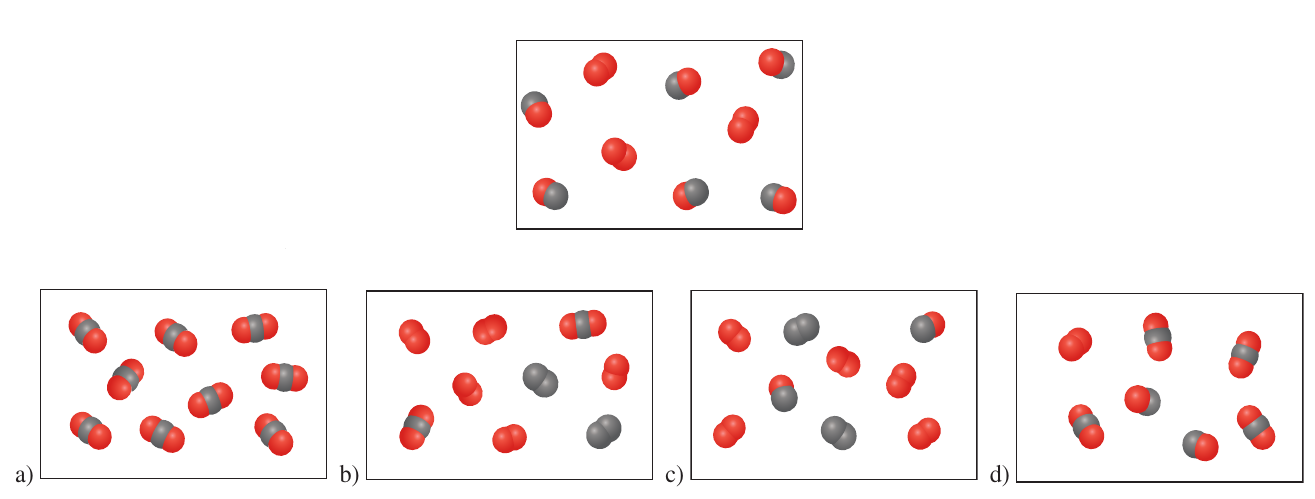
Repaso. Pregunta 6.
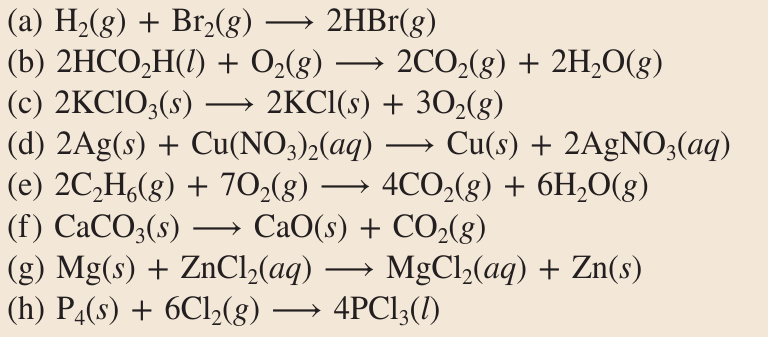
Repaso. Pregunta 7.
¿Cuáles de las siguientes reacciones químicas son ecuaciones químicas correctamente escritas?
Reacción 1: \(C_4 H_{10} + O_2 \rightarrow CO_2 + H_2 O\).
Reacción 2: \(C_4 H_{10}+6.5 O_2 \rightarrow 4 CO_2 + 5 H_2 O\).
Reacción 3: \(2C_4 H_10 + 13 O_2 \rightarrow 8 CO_2 + 10 H_2 O\).
Repaso. Pregunta 8
¿Cómo le explicaría usted a un amigo que no es de ingeniería química o de alimentos, que 10 gramos de nitrógeno no reacciona con 30 gramos de hidrógeno para formar 40 gramos de amoníaco?
\[N_2 + H_2 \rightarrow NH_3 \]
Repaso. Pregunta 9.
\[Mg + O_2 \rightarrow MgO \]
Si la figura muestra el magnesio disponible, bosqueje el oxígeno necesario para consumir exactamente el magnesio presente.
Repaso. Pregunta 10.
Reaccionan 10 gramos de nitrógeno y 5 gramos de hidrógeno. Su amigo de otra ingeniería le dice que evidentemente el reactivo limitante es el hidrógeno. ¿Qué opina usted?
Repaso. Problema 1.
Considere la siguiente reacción química:
\[ H_2 S + SO_2 \rightarrow S + H_2 O \]
¿Cuántos moles de sulfuro de hidrógeno deben reaccionar para obtener 4 moles de zufre?
¿Cuántos moles de dióxido de azufre deben reaccionar para formar 4 moles de azufre?
¿Cuántos moles de sulfuro de hidrógeno deben reaccionar para formar 4 moles de agua?
¿Cuántos moles de azufre se forman si reaccionan 5 moles de sulfuro de hidrógeno?
Repaso. Problema 2.
¿Cuánto metanol puede obtenerse a partir de las cantidades dadas de hidrógeno?
\[CO + H_2 \rightarrow CH_3 OH \]
- 65.4 mg
- 65.4 g
- 65.4 kg
Repaso. Problema 3.
Si reaccionan 49.8 gramos de amoníaco con 49.8 gramos de flúor y se obtienen 7.22 gramos de HF, ¿cuál fue el rendimiento de la reacción?
\[NH_3 + F_2 \rightarrow N_2 F_4 + HF \]
Repaso. Prpblema 4.
¿Qué volumen de HCl 0.955 M (en mililitros) se requiere para titular 2.152 g de \(Na_2 CO_3\) disueltos en agua?
\[Na_2 CO_3 (ac)+HCl \rightarrow NaCl(ac)+ CO_2 (g) + H_2 O (l)\]
Titulación.
